Alzheimer-Medikament: Hersteller liefert nur halbe Information
Pharmahersteller stellen den Nutzen ihrer Medikamente gern möglichst vorteilhaft dar. Dazu greifen sie manchmal auch in die «Trickkiste» und ändern zum Beispiel kurzerhand das ursprünglich angepeilte Ziel einer Studie. Sie streichen den Nutzen nur bei ausgewählten Patientengruppen, die profitierten, heraus (Infosperber berichtete). Oder sie zeigen Daten bloss für einen Zeitraum, der das Arzneimittel im besten Licht erscheinen lässt.
Im Fall des umstrittenen Alzheimer-Medikaments Lecanemab wäre es ein grosser Pluspunkt, wenn das Medikament den Verlauf der Krankheit positiv beeinflussen würde. Um das zu belegen, präsentierte der japanische Hersteller Eisai an der «Internationalen Konferenz der Alzheimer-Vereinigung» – einem wichtigen Kongress – 2024 eine Grafik.
In der Zulassungsstudie hatte Eisai verglichen, wie sich die geistige Verfassung bei den Versuchspersonen verschlechterte, die 18 Monate lang Lecanemab erhalten hatten, und wie es sich bei denjenigen verhielt, die nur Placebo bekamen.
Der durchschnittliche Unterschied war klein – so klein, dass manche Fachleute sogar bezweifelten, dass er für die Patienten oder die Pflegenden erkennbar ist (Infosperber berichtete). Aber er war statistisch signifikant. Das genügte für die Zulassung von Lecanemab in den USA.
Nach 36 Monaten war ein Unterschied erkennbar …
Im nächsten Schritt bekamen auch Personen in der Placebogruppe, die es wünschten, Lecanemab. Die Hypothese: Wenn das Medikament den Verlauf der Alzheimer-Krankheit nachhaltig verändert, dann müsste nach 36 Monaten ein Unterschied zwischen beiden Gruppen erkennbar sein.
Was die geistige Fitness betrifft, müssten diejenigen, die von Anfang an Lecanemab erhielten, im Vorteil sein gegenüber jenen, die es zeitversetzt erst 18 Monate später bekamen. Die «Von-Anfang-an-Gruppe» hätte folglich einen Vorsprung, den die Vergleichsgruppe nicht aufholt.
Die Grafik, die Eisai 2024 am Kongress präsentierte, schien das zu bestätigen: Nach 36 Monaten waren diejenigen, die das Medikament von Beginn an bekommen hatten, geistig besser dran als jene, die diese Behandlung mit 18 Monaten Verzögerung begannen.
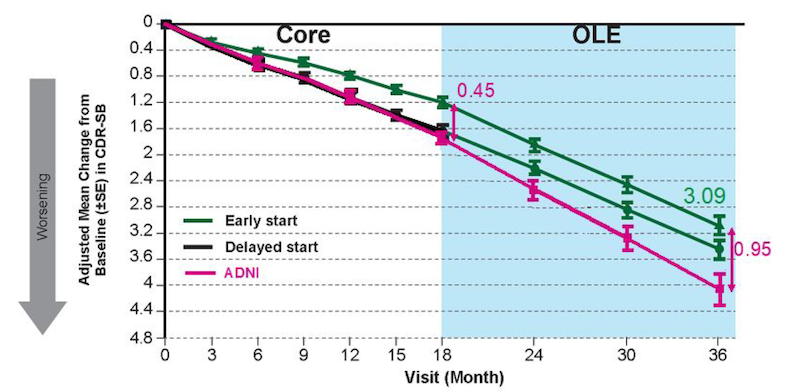
… doch dann wurde die Kurve nicht mehr fortgeführt
Ende Juli 2025 fand die diesjährige «Internationale Konferenz der Alzheimer-Vereinigung» statt. Inzwischen überblickte Eisai einen Studienzeitraum von 48 Monaten. Gespannt wartete die Fachwelt auf die Ergebnisse: Blieb der Unterschied zwischen diesen beiden Gruppen nach vier Jahren bestehen?
Doch Eisai führte die Grafik 2025 nicht fort. Der Vergleich beider Gruppen endete mit dem 18. Studienmonat. Stattdessen verglich die Pharmafirma nun den Verlauf in der Gruppe, die von Anfang an mit dem Medikament behandelt worden war, mit zwei sogenannten historischen Vergleichsgruppen aus anderen Studien, die nichts mit Lecanemab zu tun hatten.
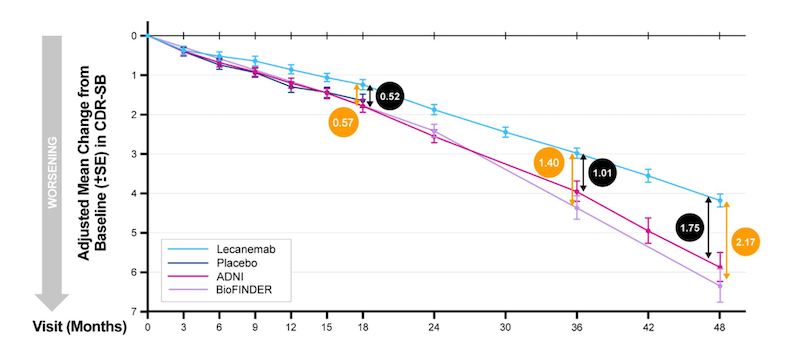
«Massiver Placebo-Effekt»
Der britische Professor für Alterspsychiatrie Robert Howard liess sich daraufhin von der US-Ärztezeitung «Jama» zitieren. Er wundere sich, warum Eisai keinen Vergleich bis zum 48. Monat nach Studienbeginn anstellte. Und er frage sich, ob der Grund vielleicht sei, dass da kein Unterschied zwischen den Gruppen mehr bestehe. Das wiederum würde darauf hindeuten, dass Lecanemab den Verlauf der Alzheimer-Krankheit längerfristig nicht verändere.
Eisai gab gegenüber «Jama» an, man habe gar nicht vorgehabt, die Gruppen länger als 36 Monate zu vergleichen. Denn es gebe zu viele Faktoren, die da hineinspielten und die Ergebnisse verzerren könnten.
Während manche Fachleute neue Alzheimer-Medikamente wie Lecanemab oder Donanemab für den Beginn einer neuen Behandlungsära halten, spricht Howard von einem «massiven Placebo-Effekt». Kollegen in Japan und Südkorea, die Patienten mit neuen Alzheimer-Medikamenten behandelten, hätten ihm gesagt, dass «wir nur sehen, dass sich der Zustand der Menschen genauso verschlechtert wie ohne Behandlung».
Verräterische Nebenwirkungen
Bereits 2023 hatte der niederländische Neurologie-Professor Willem van Gool in der Fachzeitschrift «Brain» darauf hingewiesen, dass nach der Infusion von Lecanemab rund 26 Prozent der Behandelten Schüttelfrost, Schmerzen, Übelkeit oder andere Symptome bekamen. In der Placebogruppe sei dies nur bei etwa 7 Prozent passiert. Folglich sei es für die betroffenen Patienten, ihre Betreuer und die behandelnden Ärzte leichter gewesen, zu erraten, wer höchstwahrscheinlich Lecanemab erhalten hatte und wer nicht. «Meine Prognose wäre, dass die Studienteilnehmer mit Infusionsreaktionen, sowohl in der Lecanemab- als auch in der Placebo-Gruppe, um etwa 25 Prozent besser abschneiden als diejenigen ohne», prophezeite van Gool. Doch eine solche veröffentlichte Auswertung gibt es bisher nicht.
Wenn van Gools Einschätzung zuträfe, wäre der kleine nachweisbare Effekt des Medikaments wohl vor allem seiner Placebo-Wirkung zu verdanken.
Themenbezogene Interessenbindung der Autorin/des Autors
Keine
_____________________
➔ Solche Artikel sind nur dank Ihren SPENDEN möglich. Spenden an unsere Stiftung können Sie bei den Steuern abziehen.
Mit Twint oder Bank-App auch gleich hier:
_____________________
Meinungen in Beiträgen auf Infosperber entsprechen jeweils den persönlichen Einschätzungen der Autorin oder des Autors.











Das Vorgehen des Herstellers wirkt unseriös. Wenn man wirklich nicht die Absicht hätte, die Wirkung länger als 36 Monate zu beobachten, dann würde man auch keine fragwürdigen Vergleiche mit Probanden aus anderen Studien über 48 Monate präsentieren. In jedem Falle wäre eine kurzfristige Anlage eines Versuchs bei Alzheimer seltsam, denn es ist ja hier zentral, ob ein Medikament auch über einen längeren Zeitraum wirkt.
Das riecht doch sehr danach, dass man die Studie abgebrochen hat, weil sich eine längerfristige Unwirksamkeit abzuzeichnen drohte.